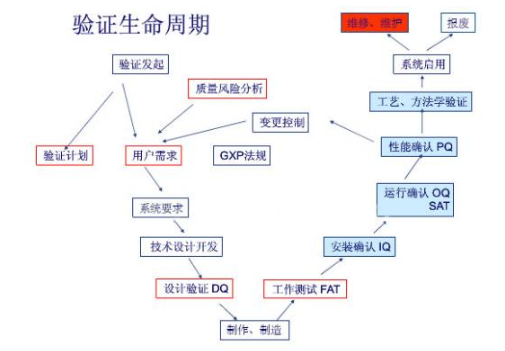
设备验证是指对生产设备的设计、选型、安装及运行的正确性以及工艺适应性的测试和评估,证实该设备能达到设计要求及规定的技术指标。
设计确认(以下简称DQ)又称预确认,是设备验证工作的第一步,是指制药企业评价设备技术指标并遴选最优设备供应商的过程。
也就是说,企业要进行设备验证,就是先根据药品生产工艺的设计情况,对生产所用的设备进行设计和选型。一般是参照说明书从设备的性能及设定的参数等方面进行考查。最后由企业相关部门写出验证报告,经审核批准,最后选定设备供应厂商。
第138条:企业应当确定需要进行的确认或验证工作,以证明有关操作的关键要素能够得到有效控制。确认和验证的范围和程度应当经过风险评估来确定。 第139条:企业的厂房、设施、设备和检验仪器应当经过确认,应当采用经过验证的生产工艺、操作规程和检验方法进行生产、操作和检验,并保持持续的验证状态。 第140条:应当建立确认与验证的文件和记录,并能以文件和记录证明达到以下预定的目标: (1)设计确认应当证明厂房、设施、设备的设计符合预定用途和本规范要求; (2)安装确认应当证明厂房、设施、设备的建造和安装符合设计标准; (3)运行确认应当证明厂房、设施、设备的运行符合设计标准; (4)性能确认应当证明厂房、设施、设备在正常操作方法和工艺条件下能够持续符合标准; (5)工艺验证应当证明一个生产工艺按照规定的工艺参数能够持续生产出符合预定用途和注册要求的产品。
2010版GMP第一次引入了风险评估概念,在第七章还要求“确认和验证的范围和程度应当经过风险评估来确定”。
所以要展开DQ工作首先是要对工艺设备进行风险分析,然后形成用户需求标准URS。
一般的,从工艺出发,确定设备验证范围有如下几类:1)对工艺路线图上所有的设备做风险分类。2)直接或间接影响药品质量的,或与生产工艺过程、质量控制、环境、安全和数据真实性等相关的设备做验证。3)依据设备用途和工艺要求等对这类设备做风险分析。
做好风险分析后,还需编制符合本公司的URS。强调制药设备应满足药品生产企业的需求,以及用户对产品性能、技术、使用、服务等的要求。而风险评估也应作为URS的内容在合同中明确提出。
可以说,DQ工作就是对URS各项要求的确认,URS中的各项陈述就是DQ工作的接受标准。因此,一份编写良好的URS是DQ顺利进行的必要条件。
GMP的核心思想之一就是“药品的质量不是检验出来的,是生产出来的,更是设计出来的”,这个“设计”既包括生产工艺设计,同时也是与生产工艺密切相关的制药设备的设计。
制药企业必须认识到设计确认是制药设备验证工作中最基础也是最重要的一环,那么接下来需要根据生产工艺对设备的功能、材质、结构的特定要求开展设计确认工作:
1、设备功能确认
由于药品生产的特殊性,制药企业宜从设备的洁净功能、清洗功能、在线监测与控制功能以及安全保护功能进行分析。具体考察内容详见表1。
表1:设备功能确认项目表
功能考察项 | 具体考察内容 | 接受标准 |
洁净功能 | 对设备与所加工药物(物料)进行物理或化学测试,以及密闭性能测试,并对测试结果进行分析以形成规范性的测试结果和分析文件。 | 设备不得与所加工的物料发生化学反应(设备密封及结构设计缺陷,药液、清洗剂、污物交互渗漏侵蚀,导致几者之间的相互污染,甚至影响设备性能等);物理反应(如物料粘连)应在可接受范围之内;密闭性能良好,即“不见阳光”的装置。 |
清洗功能 | 设备是否具备在线清洗功能,在线清洗的效果是否符合要求;若需人工清洁,应根据设备的特点制定清洁验证方案,做好清洁验证。 | 无论采取何种形式的清洁方式(包括在线清洗和非在线清洗,自动清洗和人工清洗等),清洁效果必须符合规定的标准,不对环境和药品产生影响。 |
在线监测与控制功能 | 是否是PLC控制,是否具备良好的人机对话界面,操作是否简单易学,是否易于维护,参数修改是否设置相应的权限。 | 人机对话界面应简单、易于操作;界面应能动态反映主要工序的情况;应有工艺菜单的选择及参数的设定并显示设定参数曲线、实际工作参数曲线、统计数据以及故障原因等;已设定的参数和曲线进行实时修改的权限设置合理科学。 |
安全功能 | 定量(设置严格的数量标准)测试设备的防尘、防水、防过热、防爆、防渗入、防静电、防过载等保护功能;某些非正常情况下的保护功能测试。(如:高速运转设备的“紧急制动”;高压设备的“安全阀”;粉体动轴密封不得向药物方面泄露的结构;以及无瓶止灌、自动废弃、卡阻停机、异物剔除等) | 所有的安保功能测试结果必须符合设备制造商声明的标准。 |
2、设备材质确认
GMP规定制造设备的材料不得对药品性质、纯度、质量产生影响,其所用材料需具有安全性、辨别性及使用强度。可分为:
(1)在药物等介质的腐蚀性,接触性,气味性的环境条件下不发生反应,不释放微粒,不与所生产的药物或有要求的工艺介质发生化学反应或吸附。
(2)对于金属材料,凡与药物及腐蚀性介质接触的以及潮湿环境下工作的均应选用低含碳量的不锈钢材料、钛及钛复合材料或铁基涂覆耐腐蚀、耐热、耐磨等涂层的材料制造。
(3)非金属材料的选择原则是无毒性、耐腐蚀,即:不应是松散状的、掉渣、掉毛的,特殊用途的还应结合材料的耐热、耐油、不吸附、不吸湿等性质考虑选用,密封填料和过滤材料尤应注意卫生性能的要求。
3、设备结构确认
设备的结构具有不变性,一旦投入使用不合理、不适用的设备,要做更改几乎是不可能的。因此,设备的结构对生产的影响是先决的,对设备结构的考察也是DQ工作的重中之重,设备结构的确认可根据表2展开。
表2:设备结构确认考察表
结构确认 | 考察内容 | |
主体部件 | 主体部件应有利于物料的流动、位移、反应、交换及清洗等,尽可能采用大的圆角、斜面、锥角等以免挂带和阻滞物料。 | |
辅助部件 | 传动部件 | (1)诸如分度、变速机构特点、分度精度或变速范围、以及使用寿命。 (2)传动平稳和低噪声性,以及传动部分不对操作部分产生污染的措施。 |
润滑系统 | (1)润滑要求和润滑方法是否有自动控制润滑的功能;润滑时间和流量是否可调,缺润滑剂报警功能。 (2)润滑密封的措施,润滑剂的渗漏率,以及对整个系统不产生油污染的措施。 | |
安全系统 | 安全装置是否能安全离合或起超载离合作用。 | |
其它 | 对气动或液压控制系统,控制原理、主要配置、主要参数以及其它功能。 | |
最后说一下设备供应商的遴选。在确定设备的关键参数后,接下来的工作就是根据产品工艺属性和设备关键参数遴选出最优的设备供应商。具体可从以下几方面开展(表3):
表3:供应商资质审查
序号 | 供应商资质审查内容 |
1 | 设备供应商在此之前有提供此类设备的经验(同时供应商应提供资格证书:如压力容器生产资格证明) |
2 | 供应商的财政稳定程度 |
3 | 供应商的信誉 |
4 | 供应商提供技术培训的水平 |
5 | 供应商是否在所在地进行设备的性能测试 |
6 | 供应商提供试车资料及测试保障 |
7 | 确认用户需求和设备生产环境 |
8 | 供应商的同类设备在其他厂家的使用经验(必要时可提供联系电话、组织参观等) |
9 | 供应商能否保证执行交货期 |
10 | 供应商对规范熟悉的程度 |
11 | 是否具有完整的,符合国家标准的,能够指导生产制造的技术文件(如设备说明书、设备标准操作规程等) |
在确定设备供应商后,应对设备供应商的质量保证体系进行现场审查。检查设备的技术文件(如:P&ID,施工图等)是否考虑到用户要求标准(URS)及GMP的要求,设备所用的材质、结构、外观、功能性能是否符合产品质量标准。
此外,制药企业还应参与设备制造商的工厂验收试验(FAT),并详细记录各项试验数据,为之后设备进入生产现场后进行的SAT,IQ,OQ,PQ等工作做好铺垫。
结语:
验证不是目的,只是产品质量的保障。提升技术装备水平,提高设备风险评估和URS的水平,才能生产出质量合格的药品,这个是前提,是基础。对设备确认工作的各项也要按照标准严格执行。